活动倒计时
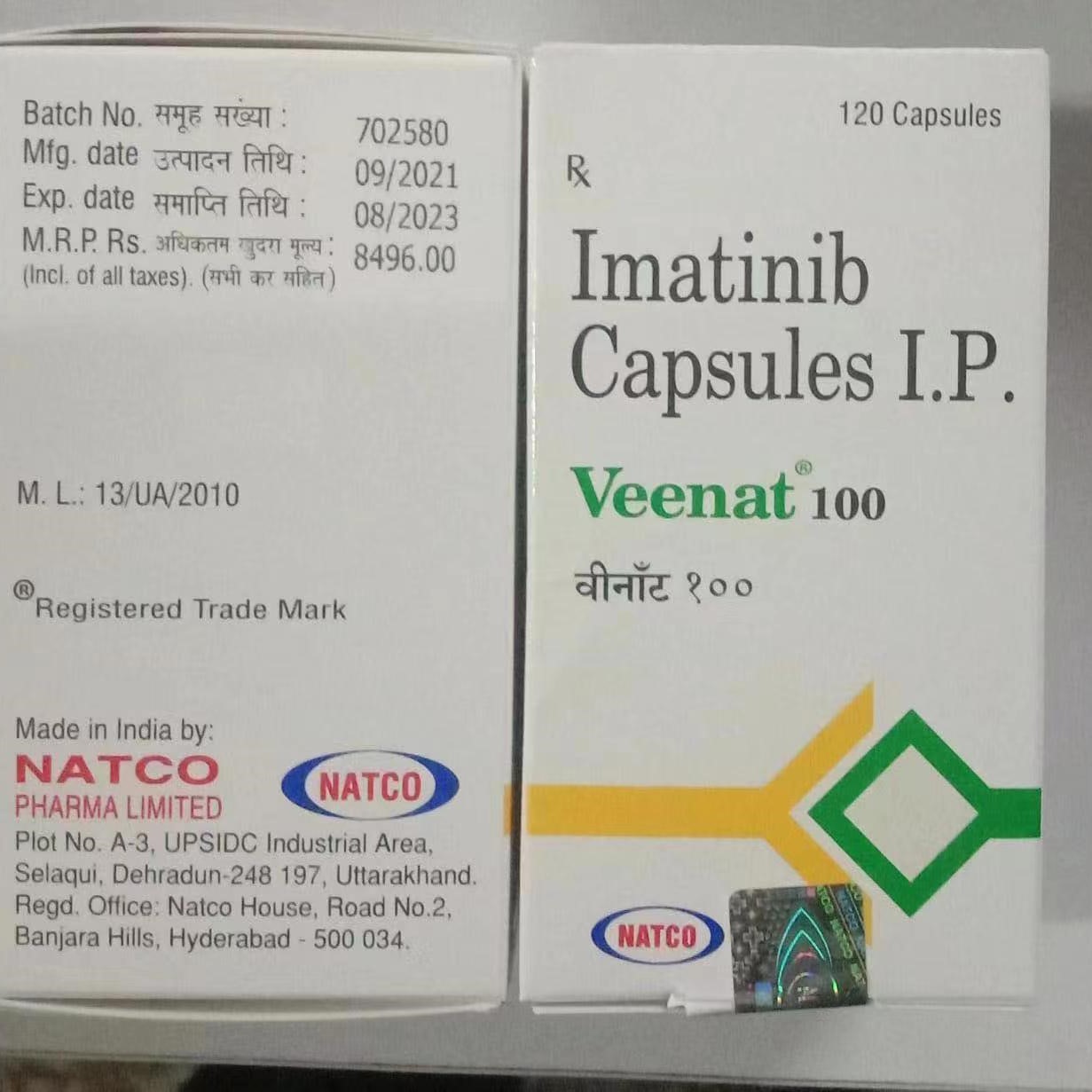
- 伊马替尼(格列卫)120粒装 Imatinib Veenat 100 甲磺酸伊马替尼 印度Natco格列宁慢性粒细胞白血病药
- 伊马替尼格列卫甲磺酸格列宁
产品介绍
用于治疗慢性粒细胞白血病(CML)急变期、加速期或α-干扰素治疗失败后的慢性期患者 ;不能手术切除或发生转移的恶性胃肠道间质肿瘤(GIST)患者。
【说明书】
1 适应症和用途
1.1 新诊断费城阳性慢性粒性白血病(Ph+ CML)
新诊断费城染色体阳性慢性粒性白血病慢性期成年患者。
1.2干扰素-α (IFN)治疗后Ph+ CML原始母细胞危象(BC),加速期(AP)或慢性期(CP)
干扰素-α治疗失败后原始母细胞危象,加速期,或慢性期费城染色体阳性慢性粒性白血病患者。
1.3 Ph+ CML慢性期患儿
新诊断或干细胞移植后疾病复发或对干扰素-α治疗耐药的Ph+ CML慢性期患儿。在患儿无对照试验证实临床效益,例如疾病相关症状或增加生存改善。
1.4 Ph+ 急性淋巴细胞白血病(ALL)
复发或难治性费城染色体阳性急性淋巴细胞白血病成年患者。
1.5骨髓发育异常/骨髓增生性疾病(MDS/MPD)
骨髓发育异常/骨髓增生性疾病伴随PDGFR(血小板衍生生长因子受体)基因重排成年患者。
1.6侵袭性系统性肥大细胞增多症(ASM)
有侵袭性系统性肥大细胞增多症无D816V c-Kit突变或有未知c-Kit突变状态成年患者。
1.7高嗜酸性综合征(HES)和/或慢性嗜酸性白血病(CEL)
有FIP1L1-PDGFR融合激酶(突变性分析或萤光原位免疫组化[FISH]证实CHIC2等位基因缺失)高嗜酸细胞综合征和/或慢性嗜酸性白血病成年患者和有HES和/或CEL是FIP1L1-PDGFR融合激酶阴性或未知患者.
1.8 隆凸性皮肤纤维肉瘤(DFSP)
不可切除,复发性和/或转移性隆凸性皮肤纤维肉瘤成年患者。
1.9 Kit+ 胃肠道间质瘤(GIST)
有Kit(CD117)阳性不可切除和/或转移恶性胃肠道间质瘤患者。
1.10 GIST的辅助治疗
Kit(CD117)阳性GIST完全切除后成年患者的辅助治疗。
2 剂量和给药方法
如适当时应由对血液学恶性病或恶性肉瘤患者治疗有经验的医生开始治疗。处方剂量应随进餐和一大杯水口服给药。应给予400 mg或600 mg剂量每天1次,而800 mg应给予400 mg一天2次。
在儿童中,格列卫治疗可给予每天1次给药或另一种方法是每天给药可分成两次- 1次在早晨和1次在傍晚。没有2岁以下儿童格列卫治疗的经验。
对不能吞服薄膜衣片患者,可将片分散在一杯水或苹果汁。应将所需片数放在适当容积饮料中(对100 mg片约50 mL,和400 mg片200 mL)和用匙搅拌。片完全崩解后应立即给予混悬液。
为每天给予800 mg和以上,应用400 mg片完成给药减低暴露于铁。
无进展疾病或不可接受毒性的证据时可继续长期治疗。
2.1有Ph+ CML CP, AP和BC成年患者
对慢性期CML成年患者格列卫的推荐剂量是400 mg/day和对成年患者加速期或原始母细胞危象600 mg/day。
在CML中,慢性期病成年患者剂量增加从400 mg至600 mg,或从600 mg至800 mg(给予400 mg每天2次) 在加速期或原始母细胞危象成年患者中在缺乏严重不良药物反应和严重非白血病相关中性粒细胞减少或血小板减少在下列情况可以考虑:疾病进展(在任何时),至少3个月治疗后未能达到满意血液学缓解,6-12个月治疗后未能达到细胞遗传学缓解,或丧失既往达到血液学或细胞遗传学缓解。
2.2 有Ph+ CML患儿
新诊断Ph+ CML儿童格列卫的推荐剂量是340 mg/平方米/day(不超过600 mg)。干细胞移植后Ph+ 慢性期CML复发或对干扰素-α治疗耐药儿童推荐的格列卫剂量是260 mg/平方米/day。
2.3 Ph+ ALL
对复发/难治性Ph+ ALL成年患者格列卫的推荐剂量是600 mg/day。
2.4 MDS/MPD
对MDS/MPD成年患者格列卫的推荐剂量是400 mg/day。
2.5 ASM
对无D816V c-Kit突变ASM成年患者格列卫的推荐剂量是400 mg/day。如c-Kit突变状态不知道或不能利用,对其它治疗ASM缓解不满意患者可考虑用格列卫400 mg/day治疗。对ASM伴随嗜酸粒细胞增多,一种与融合激酶FIP1L1-PDGFR相关克隆血液病患者,建议起始剂量100 mg/day。在缺乏不良药物反应如评估证实对治疗反应(缓解)不充分患者可考虑剂量从100 mg增加至400 mg。
2.6 HES/CEL
对HES/CEL成年患者格列卫的推荐剂量是400 mg/day。对证实FIP1L1-PDGFR融合激酶HES/CEL患者,建议起始剂量100 mg/day。在缺乏不良药物反应如评估证实对治疗反应(缓解)不充分患者可考虑剂量从100 mg增加至400 mg。
2.7 DFSP
对DFSP成年患者格列卫的推荐剂量是800 mg/day。
2.8 GIST
对不可切除和/或转移,恶性GIST成年患者格列卫的推荐剂量是400 mg/day。当临床上有指针,在较低剂量显示疾病进展的明确征象和症状和缺乏严重不良药物反应患者中可考虑剂量增加直至800 mg每天(给予400 mg每天2次)。
GIST完全大部切除后的辅助治疗成年患者格列卫的推荐剂量是400 mg/day。在临床研究中格列卫被给予1年。不知道用格列卫的最优治疗时间。
2.9 调整剂量指导
同时强CYP3A4诱导剂:应避免同时使用强CYP3A4诱导剂 (如,地塞米松[dexamethasone]、苯妥英[phenytoin]、卡马西平(carbamazepine)、利福平(rifampin)、利福布汀(rifabutin)、利福喷丁(rifapentin)、利福平[rifampacin]、苯巴比妥(Phenobarbital))。如患者必须与强CYP3A4诱导剂共同给药,根据药代动力学研究,格列卫的剂量应至少增加50%,和应仔细监视临床反应[见药物相互作用(7.1)].
肝受损:轻和中度肝受损患者无需调整剂量而按推荐剂量治疗。有严重肝受损患者应使用推荐剂量减低25% [见特殊人群中使用 (8.6)]。
肾受损:中度肾受损患者(CrCL = 20-39 mL/min)应接受推荐起始剂量减低50%和如耐受将来剂量可增加。在轻度肾受损患者(CrCL = 40-59 mL/min)中建议剂量不要大于600 mg。对中度肾受损患者建议剂量不大于400 mg。
严重肾受损患者中应慎用伊马替尼。两例严重肾受损患者耐受100 mg/day剂量[见特殊人群中使用(8.7)]。
3 对肝毒性和非血液学不良反应调整剂量
If elevations in 胆红素>3 × 机构肝正常上限(IULN)或肝转氨酶发生 >5 × IULN,应暂停格列卫直至胆红素水平已返回至<1.5 × IULN和转氨酶水平至 <2.5 × IULN。在成年中用格列卫治疗可能在减低的每天剂量继续(即,400 mg减低至300 mg,600 mg至400 mg或800 mg至600 mg)。在儿童中,在相同情况下每天剂量可能减低,分别从340 mg/平方米/day至260 mg/平方米/day或从260 mg/平方米/day至200 mg/平方米/day。
如发生严重非血液学不良反应(例如严重肝毒性或严重液体潴留),应暂停格列卫直至事件已解决。其后,如适当治疗可恢复依赖于事件初始严重程度。
4 禁忌证:无。
5 警告和注意事项
5.1 液体潴留和水肿
格列卫常伴随水肿和偶然严重液体潴留[见不良反应(6.1)]。患者应称重和定期监视液体潴留征象和症状。应仔细研究非预期的迅速增重和提供适当治疗。CML研究中随较高格列卫剂量和年龄>65岁水肿概率增加。新诊断CML患者服用格列卫报道严重浅表水肿1.5%,和其它成年CML患者服用格列卫2%-6%。此外,新诊断CML患者服用格列卫报道其它严重液体潴留(如,胸腔积液,心包积液,肺水肿,和腹水)反应1.3%,和其它成年CML患者服用格列卫2%-6%。GIST服用格列卫患者报道严重液体潴留9%至13.1% [见不良反应(6.11)]。
5.2 血液学毒性
格列卫治疗伴随贫血,中性粒细胞减少,和血小板减少。头一个月应每周进行全面血细胞计数,第二个月每两周,和而后定期以及临床上有指针时(例如,每2-3个月)。在CML中,全血细胞减少发生依赖于疾病期和加速期CML或原始母细胞危象患者比慢性期CML患者更频。CML患儿观察到最频毒性是3或4级全血细胞减少包括中性粒细胞减少,血小板减少和贫血。一般发生在治疗头几月内[见剂量和给药方法(2.11)]。
5.3 严重充血性心衰和左室功能障碍
服用格列卫患者偶尔报道严重充血性心衰和左室功能障碍。报道心脏反应患者大多数有其它共同患病和风险因子,包括高龄和既往心脏病史。一项国际随机化3期研究,1,106例新诊断Ph+ CML慢性期患者中,观察到0.7%服用格列卫患者有严重心衰和左室功能障碍,与此相比用IFN + Ara-C患者为0.9%。应仔细监视有心脏病或心衰风险因子患者和应评价和治疗任何有心衰征象和症状的患者。
5.4 肝毒性
用格列卫可能发生肝毒性,偶尔严重[见不良反应(6.3)]。开始治疗前和每月,或临床上有指针时应监查肝功能(转氨酶,胆红素,和碱性磷酸酶)。应用中断和/或减低格列卫治疗剂量处理实验室异常[见剂量和给药方法(2.10)]。
当格列卫与化疗联用时,曾观察到以转氨酶升高和高胆红素血症形式的肝毒性。此外,曾报道急性肝衰竭。建议监视肝功能。
5.5 出血
在新诊断CML试验中,1.8%患者有3/4级出血。在3期不可切除或转移GIST研究中211例患者(12.9%)报道在任何部位3/4级出血。在2期不可切除或转移GIST研究中7例患者(5%)有总共8例CTC3/4级出血;胃肠道(GI) (3例患者),瘤内(3例患者)或兼有(1例患者)。胃肠道肿瘤部位可能是GI出血的来源。
5.6 胃肠道疾患
格列卫有时伴随胃肠道刺激。应与食物和一大杯水服用格列卫使这个问题最小化。曾有罕见报道,包括胃肠道穿孔死亡。
5.7 高嗜酸性心脏毒性
伴随开始用格列卫治疗曾有高嗜酸细胞综合征和涉及心脏患者,心源性休克/左室功能障碍病例。报道给予全身皮质甾体,循环支持疗法和暂停格列卫可逆转此情况。伴随高嗜酸性水平可有骨髓发育异常/骨髓增生病和系统性肥大细胞增多症。所以伴随高嗜酸性水平有HES/CEL患者,和有MDS/MPD或ASM患者考虑进行超声心动图和测定血清肌钙蛋白。如任一检查异常,格列卫开始治疗时应考虑同时预防性使用全身皮质甾体(1-2 mg/kg)1至2周。
5.8 皮肤学毒性
使用格列卫曾报道.大疱性皮肤病的反应,包括多形性红斑和Stevens-Johnson综合征[重症多形性红斑]。
5.9 甲状腺机能低下
曾报道甲状腺切除接受左旋甲状腺素替代治疗患者用格列卫治疗期间发生甲状腺机能低下临床病例,这类患者应严密监查TSH水平。
5.10 来自长期使用毒性
通过动物研究提示重要的是考虑潜在毒性,特别是肝,肾和心脏毒性和免疫抑制。在犬中处理2周,观察到有肝酶升高,肝细胞坏死,胆道坏死,和胆管增生等严重肝毒性。在猴中处理两周观察到肾毒性,有肾小管局灶矿物质化和扩张及小管坏死。这些动物几只观察到BUN和肌酐增加。实验室动物研究中慢性伊马替尼治疗观察到机遇性感染发生率增加。在一项39-周猴研究中,在这些动物中用伊马替尼治疗导致正常被抑制疟疾感染的恶化。在动物中观察到淋巴细胞减少(如人中)。在2年大鼠研究确定另外长期毒性。研究处理死亡大鼠病理组织学检查揭示心肌病变(两种性别),慢性进行性肾病(雌性)和包皮腺乳头状瘤为死亡主要原因或处死理由。在此2年研究所见非肿瘤病变在较早临床前研究没有确定是心血管系统,胰腺,内分泌器官和牙齿。最重要变化包括心脏肥厚和扩张,在有些动物中导致心功能不全征象。
5.11 妊娠中使用
妊娠类别D
应建议有生育力妇女在服用格列卫避免成为妊娠。服用格列卫性活动女性患者应使用适当避孕。在大鼠中在器官形成期给予甲磺酸伊马替尼剂量约等同于基于体表面积人最大剂量800 mg/day是致畸胎。雌性大鼠给予甲磺酸伊马替尼剂量基于体表面积人最大剂量800 mg/day约一半见到显著植入后丢失[见特殊人群中使用(8.1)]。
6 不良反应
因为临床试验是在广泛不同条件下进行的,某药在临床试验观察到不良反应率不能与另一药临床试验直接比较而且可能不反映实践中观察到发生率。
6.1 慢性粒性白血病
大多数格列卫-治疗患者有时经受不良反应。大多数反应是轻至中度级别,但新诊断患者的2.4%因药物相关不良反应终止药物,慢性期干扰素-α治疗失败患者为4%,加速期中4%和原始母细胞危象中为5%。
最频报道药物相关不良反应是水肿,恶心和呕吐,肌肉痉挛,肌肉骨骼痛,腹泻和皮疹(表2对新诊断CML,表3对其它CML患者)。水肿是最频眼眶周围或下肢和用利尿药,其它支持措施,或通过减低格列卫剂量处理 [见剂量和给药方法(2.10)]。严重浅表水肿频数为1.5%-6%。
代表局部或全身液体潴留的各种不良反应包括胸腔积液,腹水,肺水肿和迅速体重增加有或无浅表水肿。这些反应似乎与剂量相关,在原始母细胞危象和加速期研究更常见(其中剂量为600 mg/day),和老年人更常见。这些反应寻常用中断格列卫治疗和用利尿药或其它适当支持疗法处理。这些反应少数可以严重或危及生命,和1例原始母细胞危象患者死于胸腔积液,充血性心衰,和肾衰竭。
6.2 血液学毒性
全血细胞减少,和尤其是中性粒细胞减少和血小板减少是所有研究中的一致发现,在剂量750 mg频数较高(1期研究)。在CML中全血细胞减少的发生也依赖于患者的病期。
新诊断CML患者中比其它CML患者全血细胞减少频数较低(见表4和5)。原始母细胞危象和加速期与慢性期比较3或4级中性粒细胞减少和血小板减少的频数较高2-和3-倍间(见表4和5)。中性细胞减少和血小板减少发作中位时间分别变动于2至3周,和2至4周。
这些反应寻常可用减低剂量或中断格列卫治疗处理但罕见病例需永远终止治疗。
6.3 肝毒性
约5% CML患者中发生严重转氨酶或胆红素升高(见表4和5)和寻常用减低剂量或中断处理(这些发作的中位时间是约1周)。因为肝实验室异常而被永远终止治疗低于1.0% CML患者。1例患者为发热定期使用对乙酰氨基酚,死于肝衰竭。在2期GIST试验中6.8%患者中观察到3或4级SGPT(ALT)升高和4.8%患者观察到3或4级SGOT (AST)升高。2.7%患者观察到胆红素升高。
6.4 在儿科人群中不良反应
在93例被研究儿童中用格列卫治疗患儿的总安全性谱形与成年患者研究发现相似,除了肌肉骨骼痛频数较低(20.5%)和未报道周边水肿。恶心和呕吐是最常报道个体不良反应,发生率与成年患者所见相似。尽管研究期间大多数患儿有时经受不良反应,3/4级不良反应发生率低。
6.5 在其它子人群不良反应
在老年患者(65岁),除了水肿,更频,没有增加不良反应发生率或严重性的证据。妇女中中性粒细胞减少,以及1/2级浅表水肿,头痛,恶心,寒战,呕吐,皮疹,和疲乏频数增加。未见种族相关的差别,但对适当评价子组太小。
6.6 急性淋巴细胞白血病
Ph+ ALL如同Ph+ CML不良反应相似。在Ph+ ALL研究中最频报道药物相关不良反应是轻度恶心和呕吐,腹泻,肌肉痛,肌肉痉挛和皮疹,是容易可处理的。在所有研究中浅表水肿是常见发现和主要被述为眼眶周围或下肢水肿。罕见严重水肿和可用利尿药,其它支持性措施处理,或有些患者减低格列卫剂量。
6.7骨髓发育异常/骨髓增生性疾病
2期研究中至少10%格列卫治疗MDS/MPD患者报道的不良反应,不管与研究药物相互关系。
6.8 侵犯性全身性肥大细胞增生症[Aggressive Systemic Mastocytosis]
所有ASM患者经受至少在有些时间一种不良反应。最频繁报道不良反应是腹泻,恶心,腹水,肌肉痉挛,呼吸困难,疲乏,周边 水肿,贫血,瘙痒,皮疹和下呼吸道感染。 在2期研究中5例ASM患者无1例由于药物相关不良反应或异常实验室值终止格列卫。
6.9 高嗜酸细胞综合征[HES]和慢性嗜酸细胞白血病[CEL]
在HES/CEL患者群中的安全谱形与其它血液学恶性人群,例如Ph+ CML观察到格列卫安全谱形未表现出不同。所有患者经受至少一种不良反应,最常见是胃肠道,皮肤和肌肉骨骼疾患。血液学异常也频繁,实例CTC 3级白细胞减少,中性粒细胞减少,淋巴细胞减少和贫血。
6.10 隆凸性皮肤纤维肉瘤
在2期研究中,12例用格列卫治疗DFSP患者报道至少10%的不良反应,不管与研究药物相互关系。
在2期研究中用格列卫治疗DFSP患者12例中临床相关或严重实验室异常。
6.11 胃肠道间质瘤
不可切除和/或恶性转移GIST
在3期试验中大多数格列卫-治疗患者有时经受不良反应。最常报道不良反应是水肿,疲乏,恶心,腹痛,腹泻,皮疹,呕吐,肌肉痛,贫血和厌食。总共89例患者(5.4%)因不良反应药物被终止。浅表水肿,最频眼眶周围或下肢水肿用利尿药,其它支持性措施,或通过减低格列卫剂量处理[见剂量和给药方法(2.10)]。在182例患者(11.1%)观察到严重(CTC 3/4级)水肿。
表9中显示至少10%用格列卫治疗患者报道的不良反应,不管与研究药物相互关系。
所有级别不良反应总发生率和严重不良反应发生率(CTC 3级和以上)两治疗组间相似除水肿,在800 mg 组报道更频。
7 药物相互作用
7.1 诱导CYP3A4代谢药物
健康志愿者用多剂量利福平预治疗接着单剂量格列卫,增加格列卫口服-给药清除率3.8-倍,显著(p<0.05)减低均数Cmax和AUC。如不能给予另外治疗,应考虑调整剂量[见剂量和给药方法(2.9)]。
7.2 抑制CYP3A4代谢药物
在健康受试者中当格列卫与单剂量酮康唑[酮康唑](a CYP3A4 抑制剂)共同给药,对伊马替尼暴露显著增加(平均Cmax和AUC分别增加26%和40%)。当格列卫与强CYP3A4抑制剂给药时建议谨慎(如,酮康唑、伊曲康唑[itraconazole]、克拉霉素[clarithromycin]、阿扎那韦[atazanavir]、印地那韦[indinavir]、萘法唑酮[nefazodone]、那非那韦[nelfinavir]、利托那韦[ritonavir]、沙奎那韦[saquinavir]、泰利霉素[telithromycin],和伏立康唑[voriconazole])。柚子汁也可能增加伊马替尼的血浆浓度和应避免。抑制细胞色素P450同工酶(CYP3A4)活性物质可能减低代谢和增加伊马替尼浓度。
7.3 与被CYP3A4代谢药物的相互作用
格列卫分别增加辛伐他汀[simvastatin](CYP3A4底物)平均Cmax和AUC 2-和3.5-倍,提示格列卫对CYP3A4的抑制作用。建议当格列卫与治疗窗狭窄的CYP3A4底物给药时(如,阿芬太尼[alfentanil],环孢霉素[cyclosporine],diergotamine,麦角胺[ergotamine],芬太尼[fentanyl],匹莫齐特[pimozide],奎尼丁[quinidine],西罗莫司[sirolimus]或他克莫司[tacrolimus])要特别谨慎小心。
格列卫将增加其它CYP3A4代谢药物的血浆浓度(如,三唑苯二氮卓类[triazolo-benzodiazepines],二氢吡啶类[dihydropyridine]钙通道阻断剂,某些HMG-CoA还原酶抑制剂,等)。
因为华法林被CYP2C9和CYP3A4代谢,需要抗凝患者应接受低分子量或标准肝素替代华法林。
7.4 与被CYP2D6代谢药物相互作用
在体外,格列卫抑制细胞色素P450同工酶CYP2D6活性与影响CYP3A4活性相似浓度。于CYP2D6底物与格列卫共同给药预计增加全身暴露。未曾进行专门研究和建议谨慎。
7.5 与对乙酰氨基酚相互作用
体外,在治疗水平时格列卫抑制对乙酰氨基酚O-葡萄糖醛酸化作用(Ki值58.5 μM)。当与格列卫共同给药时对乙酰氨基酚全身暴露预计增加。在人中未曾进行专门研究和建议谨慎。
8 特殊人群中使用
8.1 妊娠
妊娠类别D[见警告和注意事项(5.11)].
当给予妊娠妇女时格列卫可能致胎儿危害。在大鼠当在器官形成期给药剂量100 mg/kg(基于体表面积约等于人最大剂量800 mg/day) 甲磺酸伊马替尼是致畸胎。致畸胎效应包括露脑畸形或脑膨出,额骨缺乏/减小和缺乏顶骨。或早期胎鼠再吸收或假死产,非活存幼畜和产后第0和第4天间早期幼畜死亡率证据表明雌性大鼠给予剂量45 mg/kg(基于体表面积约人最大剂量800 mg/day一半)也经受显著植入后丢失。在剂量较高于100 mg/kg,注意到所有动物总胎鼠丢失。在剂量30 mg/kg(人最大剂量800 mg的三分之一)未见胎鼠丢失。
在妊娠妇女中无用格列卫适当和对照良好研究,应建议当用格列卫时不要成为妊娠。如妊娠期间使用此药,或服用此药时成为妊娠,应忠告患者对胎儿的潜在危害。
8.3 哺乳母亲
伊马替尼及其活性代谢物被排泄至人乳。根据来自三例哺乳妇女服用格列卫的资料,乳汁:血浆浓度比值对伊马替尼约0.5和对活性代谢物约0.9。
考虑伊马替尼和活性代谢物的联合浓度,根据体重哺乳婴儿可能接受高达10%母体治疗剂量。因为哺乳婴儿来自格列卫的潜在严重不良反应,应做出决策是否中断哺乳或终止药物,考虑药物对母亲的重要性。
8.4 儿童使用
在新诊断Ph+慢性期CML儿童和在Ph+ 慢性期CML儿童中干细胞移植后复发或对干扰素-α治疗耐药已证实格列卫的安全性和疗效。没有2岁以下儿童中的资料。在儿童中新诊断Ph+慢性期CML随访有限。
如同成年患者,在患儿中口服给药后伊马替尼被迅速吸收,Cmax为2-4 小时。表观口服清除率与成年值(在儿童中11.0 L/hr/平方米相比在成年10.0 L/hr/平方米)相似,半衰期也一样(在儿童中14.8小时相比成年17.1小时)。在儿童中给药260 mg/平方米和340 mg/平方米二者达到成年中400 mg剂量AUC相似。每天1次重复给药后比较第8天AUC相比第1天AUC,在260 mg/平方米和340 mg/平方米剂量水平揭示分别为1.5-和2.2-倍药物积蓄。伊马替尼AUC均数不与剂量增加成正比例。
8.5 老年人使用
在CML临床研究中,约20%患者年龄大于65岁。新诊断CML患者研究中,6%患者年龄大于65岁。除了水肿较高频数外,大于65岁患者与较年轻患者比较安全性谱形未观察到差异[见警告和注意事项(5.1)]。老年和较年轻患者格列卫疗效相似。
在不可切除或转移GIST研究中,16%患者年龄大于65岁。年龄大于65岁患者与较年轻患者比较,未注意到安全性和疗效谱形明显差别,但患者数量小不允许正式分析。
在辅助GIST研究中,221例患者(31%)年龄大于65岁。年龄大于65岁患者与较年轻患者比较,除了水肿频数较高,未观察到安全性和疗效谱形差别。老年和较年轻患者格列卫疗效相似。
8.6 肝受损
在84例有不同程度肝受损癌症患者中在伊马替尼剂量范围100-800 mg评估肝受损对伊马替尼及其代谢物,CGP74588二者药代动力学的影响(表12)。轻度和中度肝受损组和正常组各组间对伊马替尼和CGP74588二者的暴露有可比性。有严重肝受损患者倾向于比正常肝功能患者对伊马替尼及其代谢物二者暴露都较高。在稳态时,严重肝受损患者与正常肝功能患者比较对伊马替尼的均数Cmax/剂均数Cmax/剂量和AUC/剂量分别增高约56%和55% [见剂量和给药方法(2.10)]。
8.7 肾受损
在59例癌症患者有不同程度肾受损(表13)在单次和稳态伊马替尼剂量范围100至800 mg/day评估肾受损对伊马替尼的药代动力学的影响。伊马替尼平均暴露(剂量归一化AUC)在轻和中度肾受损患者与正常肾功能患者比较增加1.5-至2-倍。有轻度肾受损患者中剂量大于600 mg AUCs不增加。在中度肾受损患者剂量大于400 mg时AUCs不增加。两例患者有严重肾受损被给予100 mg/day而其暴露与正常肾功能患者接受400 mg/day所见相似。有中度和严重肾受损患者无需减低剂量[见调整剂量指导(2.9)]。
10 药物过量
大于800 mg给药经验有限。曾报道格列卫过量孤立病例,在药物过量事件中,应观察患者和给予适当支持治疗。
成年过量
1,200至1,600 mg(时间变化于1至10天间):恶心,呕吐,腹泻,红斑疹,水肿,肿胀,疲乏,肌肉痉挛,血小板减少,全血细胞减少,腹痛,头痛,食欲减退。
1,800至3,200 mg(高达3,200 mg每天共6天):软弱,肌肉痛,CPK增加,胆红素增加,胃肠道疼痛。
6,400 mg(单剂量:文献报道1例患者经受恶心,呕吐,腹痛,发热,脸面肿胀,中性计数减低,转氨酶增高。
8至10 g(单剂量):曾报道呕吐和胃肠道痛。
一例患者无意中服用1,200 mg格列卫每天共6天后有粒性原始母细胞危象经受1级血清肌酐升高,2级腹水和肝转氨酶水平升高,和3级胆红素升高后治疗被暂时中断而1周内发生的所有异常完全逆转。在每天剂量400 mg恢复治疗无不良反应复发。另外一例患者服用1,600 mg格列卫每天共6天后发生严重肌肉痉挛。中断治疗后肌肉痉挛完全解决和随后恢复治疗。另1例患者处方量400 mg每天,在第1天服用800 mg格列卫和第2天1,200 mg。中断治疗,未发生不良反应和t患者恢复治疗。
儿童过量
1例3岁男患儿暴露于单剂量400 mg经受呕吐,腹泻和厌食和另1例3岁男性患儿暴露于单剂量980 mg经受白细胞计数下降和腹泻。
11 一般描述
伊马替尼是一种小分子激酶抑制剂。格列卫薄膜衣片含甲磺酸伊马替尼 等同于100 mg或400 mg伊马替尼游离碱。甲磺酸伊马替尼化学上被指定为4-[(4-Methyl-1-piperazinyl)methyl]-N-[4-methyl- 3-[[4-(3-pyridinyl)-2-pyrimidinyl]amino]-phenyl]benzamide methanesulfonate
甲磺酸伊马替尼分子式为C29H31N7O • CH4SO3和其分子量为589.7。甲磺酸伊马替尼溶于pH 5.5水性缓冲液但非常略微至不溶于中性/碱性水性缓冲液。在非水性溶剂中,原料药易溶至非常略微溶于二甲基亚砜,甲醇,但不溶于正辛醇,丙酮和乙腈。
无活性成分:胶态二氧化硅(NF);交聚维酮(NF);羟丙甲纤维素(USP);硬脂酸镁(NF);和微晶纤维素(NF)。片包衣:氧化铁,红(NF);氧化铁,黄(NF);羟丙甲纤维素(USP;聚乙二醇(NF)和滑石粉(USP)。
12 临床药理学
12.1 作用机制
甲磺酸伊马替尼是一种蛋白酪氨酸激酶抑制剂抑制bcr-abl酪氨酸激酶,在CML中由费城染色体异常造成的结构性异常酪氨酸激酶。在bcr-abl阳性细胞株以及来自费城染色体阳性慢性粒性白血病的新鲜白血病细胞中伊马替尼抑制增殖和诱导凋亡。用来自CML患者外周血和骨髓样品体外体内试验中伊马替尼抑制集落形成,
在体内,伊马替尼抑制bcr-abl转染小鼠骨髓细胞以及来自原始母细胞危象中CML患者bcr-abl阳性白血病株肿瘤生长。
伊马替尼也是血小板衍生生长因子(PDGF)和干细胞因子(SCF),c-kit受体酪氨酸激酶的抑制剂,和抑制PDGF-和SCF-介导细胞学事件。在体外,GIST细胞中伊马替尼抑制增殖和诱发凋亡,表达激活c-kit突变。
12.3 药代动力学
在健康受试者研究和超过900例患者群体药代动力学研究中曾评价格列卫的药代动力学。在CML中和GIST患者中格列卫的药代动力学相似。口服给药后伊马替尼被很好吸收,在给药后2-4小时内达到Cmax。平均绝对生物利用度为98%。在健康志愿者口服给药后,伊马替尼及其主要活性代谢物,N-去甲基衍生物(CGP74588),的消除半衰期分别是约18和40小时。从25 mg-1,000 mg范围伊马替尼平均AUC随剂量正比例增加。重复给药时伊马替尼的药代动力学无显著变化和当每天给格列卫1次在稳态时积蓄是1.5-至2.5-倍。在体外实验中临床相关伊马替尼浓度,结合至血浆蛋白约95%,大多数与白蛋白和α1-酸性糖蛋白。
CYP3A4是负责伊马替尼代谢的主要酶。其它细胞色素P450酶,例如CYP1A2,CYP2D6,CYP2C9,和CYP2C19在其代谢中起次要作用。人中主要循环活性代谢物是脱甲基哌嗪衍生物,主要通过CYP3A4形成。体外显示效力与母体伊马替尼相似。The for这个代谢物血浆AUC约为伊马替尼AUC的15%。N-脱甲基代谢物CGP74588的血浆蛋白结合与母体化合物相似。人肝微粒体研究显示格列卫是CYP2C9,CYP2D6,和CYP3A4/5强竞争性抑制剂有Ki值分别为27,7.5和8 μM。
伊马替尼主要是在粪中消除,大多数为代谢物。根据口服14C-标记剂量的伊马替尼后回收化合物,在7天内约消除81%剂量,在粪中(68%剂量)和尿(13%剂量)。未变化伊马替尼占剂量的25%(尿5%,粪20%),其余是代谢物/
典型地,在1例50岁体重50 kg患者中伊马替尼的清除率预计是8 L/h,而对50岁体重100 kg患者清除率将增加至14 L/h。患者间清除率的变异性40%不是根据体重和/或年龄调整初始剂量的根据但表明需要严密监视治疗-相关毒性。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
在2-年大鼠致癌性研究中给予伊马替尼15,30和60 mg/kg/day导致雄性在60 mg/kg/day和雌性在30 mg/kg/day统计意义寿命缩短。肿瘤变化目标器官为肾(肾小管和肾盂),膀胱,尿道,包皮和阴蒂腺,小肠,甲状旁腺,肾上腺和非腺体胃。在30 mg/kg/day对肾,膀胱,尿道小肠甲状旁腺,肾上腺和非腺体胃未见肿瘤病变,而15 mg/kg/day对包皮和阴蒂腺未见肿瘤病变。在30和60 mg/kg/day注意到的包皮/阴蒂腺的乳头状瘤/癌,代表分别约为人每天在400 mg/day或800 mg/day暴露(根据AUC)的0.5至4或0.3至2.4倍,和在儿童中每天(根据AUC)在340 mg/平方米时暴露的约0.4至3.0倍。在60 mg/kg/day时注意到肾小管腺瘤/癌,肾盂移行细胞肿瘤,膀胱和尿道移行细胞乳头状瘤,小肠腺癌,甲状旁腺腺瘤,良性和恶性肾上腺髓肿瘤和非腺体胃乳头状瘤/癌。不知道在大鼠致癌性研究中这些发现对人的关联。
在体外哺乳动物细胞分析(中国仓鼠卵巢)对致断裂作用(染色体畸变)在存在代谢激活中得到伊马替尼阳性遗传毒性作用。制造过程的两个中间体,也存在与最终产品,在Ames试验中对突变发生阳性。这些中间体之一在小鼠淋巴瘤试验中也是阳性。当在体外细菌细胞分析(Ames试验),一种体外哺乳动物细胞分析(小鼠淋巴瘤)和一种体内大鼠微核分析试验伊马替尼不是遗传毒性。
在一项生育力研究中,雄性大鼠交配前在60 mg/kg时, 基于体表面积最大临床剂量800 mg/day约四分之三给药共70天和雌性大鼠在交配前给药14天并直至妊娠第6天。睾丸和附睾重和活动精子百分率减低。剂量20 mg/kg (人最大剂量800 mg四分之一)时未见。雄性和雌性大鼠的生育力不受影响。
在一项出生前和后发育研究,在雌性大鼠给予甲磺酸伊马替尼45 mg/kg(基于体表面积约人最大剂量800 mg/day一半)从妊娠第6天直至哺乳结束,注意到在妊娠第14或15天红色阴道分泌物。
在相同剂量水平第一子代平均体重自出生直至最终处死体重减低。第一子代生育力不受影响但注意到在45 mg/kg/day时生殖效应包括再吸收数增加和活存胎鼠数减少。
在临床前生育力和早期胚胎发育研究生育力不受影响尽管在高剂量雄大鼠中观察到睾丸和附睾重较低以及活动精子数减少。在大鼠临床前出生前和后研究,在第一子代生育力也不受格列卫影响。
尚未进行对男性患者接受格列卫和其对男性生育力和精子生成影响的人研究。男性患者担忧用格列卫治疗对他们的生育力应咨询他们的医生。
14 如何供应储存和处理
贮存和处理:贮存在25°C(77°F);外出时允需至15-30°C (59-86°F)[见美国药典控制室温]。防潮。按美国药典在密封容器中发放。应考虑适当处置和遗弃抗癌药的方法。这个问题已发布几个指导原则。不要压碎格列卫片。应避免压碎片与皮肤或粘膜直接接触,如发生接触时按参考文献彻底冲洗。人员应避免暴露于压碎片。[见非临床毒理学(13.1)].